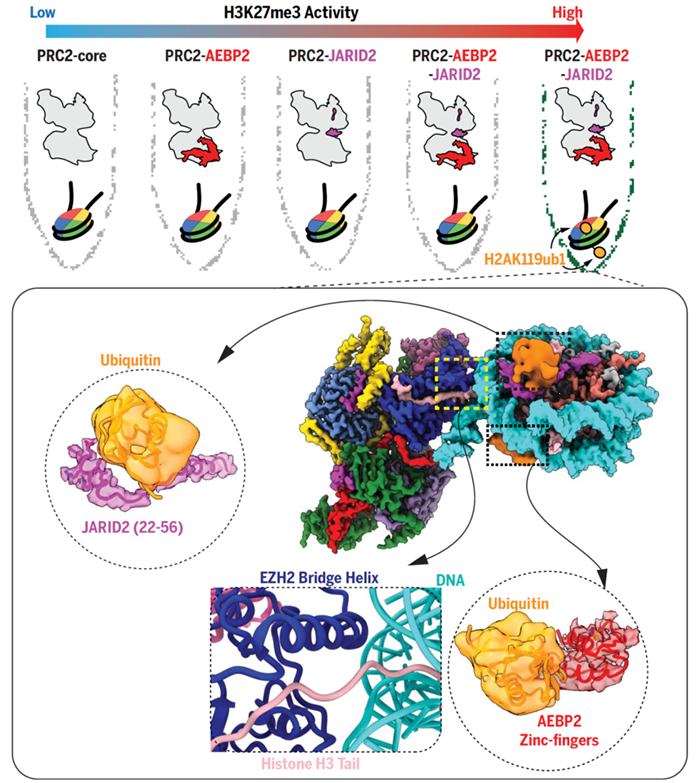
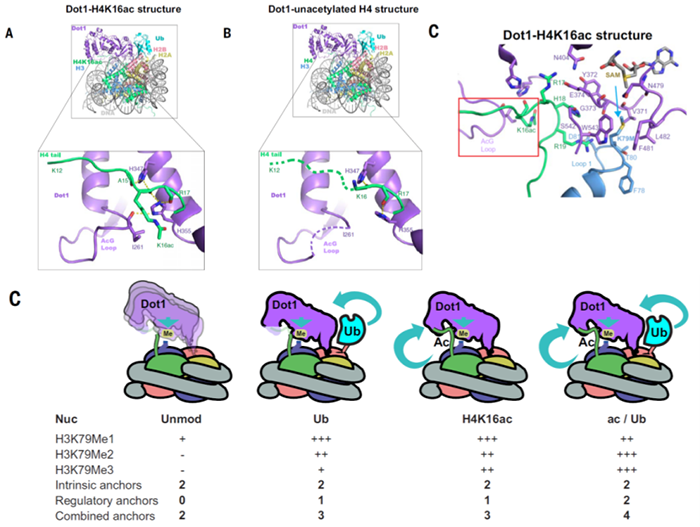
真核细胞的DNA包装在染色质中,以核小体为重复单元。每个核小体由H2A、H2B、H3、H4组成的组蛋白八聚体及在其上缠绕约145-147 bp DNA构成。组蛋白的尾部伸出核小体,存在很多翻译后修饰,这些修饰对于转录、复制、DNA损伤修复等涉及染色质的生物学过程均有调控作用。为了对这些过程进行精细调控,组蛋白修饰之间以及组蛋白修饰与其它组蛋白修饰酶之间存在着复杂的cross-talk【1,2】。多梳抑制复合体(Polycomb repressive complexes,PRC)于40多年前在黑腹果蝇的研究中首先被鉴定出来,在早期胚胎发育过程中它能够抑制同源异形(Hox)基因的表达【3】。PRC1是一个E3泛素连接酶,催化H2AK119位点的单泛素化修饰。由于辅因子的不同,PRC2有两种主要变体,分别为包含JARID2和AEBP2的PRC2.2和包含PHF1、MTF2、PHF19或EPOP或PALI1的PRC2.1。PRC2核心由EZH2、EED、SUZ12、RBAP46/RBAP48构成,催化H3K27位点的单、双、三甲基化【4】。多梳异染色质结构域的建立需要PRC1和PRC2间复杂的cross-talk,H2AK119ub1的缺失会导致相应位点H3K27me3的减少,PRC2.2能够识别H2AK119ub1,但具体细节目前并不清楚。此外,PRC2.2还能定位于同时含有H3K4me3和H3K27me3的二价区域,PRC2如何在激活marker存在下保持甲基转移酶活性目前也不清楚。Dot1(Disruptor of telomeric silencing-1)催化酵母H3K79位点的单、双、三甲基化,与转录激活相关,其哺乳动物中的同源蛋白Dot1L对于胚胎发育、造血功能以及心脏功能是必须的【5】。H2BK123位点的单泛素化对于Dot1高效催化H3K79二甲基化和三甲基化是必须的,最近的结构研究揭示了H2BK120ub1激活Dot1L酶活性的作用机制。此外,Dot1的酶活性还受到组蛋白乙酰化修饰的影响,激活或抑制组蛋白去乙酰化酶都能够影响H3K79的甲基化水平,但是组蛋白乙酰化调控Dot1酶活性的机制目前并不清楚。2021年1月22日,美国加利福尼亚大学Eva Nogales教授团队和纽约大学医学院Karim-Jean Armache教授团队发表在Science上的两项工作,通过冷冻电镜结构解析和生化实验验证,分别回答了这两个问题。Eva Nogales教授团队的工作JARID2 and AEBP2 regulate PRC2 in the presence of H2AK119ub1 and other histone modifications,通过解析包含AEBP2和JARID2的PRC2复合体与H2AK119ub1修饰的核小体的冷冻电镜结构,他们发现JARID2识别H2AK119位点上的泛素与保守的H2A-H2B酸性patch;AEBP2识别H2AK119位点上的泛素与H2A-H2B另一侧的表面。这项为PRC2复合体结合核小体提供了除EZH2与核小体DNA及H3尾巴相互作用以外的另外两个锚定位点。从而证实辅因子JARID2和AEBP2通过识别H2AK119ub1修饰能够起到募集和激活PRC2的作用。此外,通过酶活实验和解析包含AEBP2和JARID2的PRC2复合体与H3K4me3修饰的核小体的冷冻电镜结构,发现PRC2复合体与H3K4me3修饰的核小体的相互作用与H2AK119ub1修饰的核小体没有明显区别,但是H3K4me3修饰的核小体的H3尾部不能稳定定位在EZH2的活性中心,因此PRC2在含有激活修饰marker的核小体上酶活性被减弱。Karim-Jean Armache教授团队的工作Regulation of the Dot1 histone H3K79 methyltransferase by histone H4K16 acetylation,首先通过酶活实验证明H4 N端的乙酰化修饰中只有H4K16ac能够激活Dot1的甲基转移酶活性,然后解析了Dot1与H4K16ac、H2BK123ub1修饰的核小体相互作用的冷冻电镜结构以及Dot1与仅H2BK123ub1修饰的核小体相互作用的冷冻电镜结构,通过比较发现H4K16ac能够稳定Dot1活性中心附近的局部构象,从而激活Dot1的酶活性。此外,阐明了酵母Dot1与H2BK123ub1以及H2A-H2B酸性patch的相互作用。根据实验结果,他们进而提出Dot1酶活性cross-talk调控的模型:H2A-H2B酸性patch和H4提供基本锚定,这足以使Dot1具有H3K79单甲基化酶活性;H4K16ac和H2BK123ub1提供关键调节性锚定,使得Dot1能够具有H3K79双甲基化和三甲基化酶活性;同时具有H4K16ac和H2BK123ub1修饰的核小体能够给Dot1提供最好的锚定,使其具有最优的催化构象和最高的H3K79三甲基化酶活性。染色质状态的调控是精细的,这就需要多种翻译后修饰与酶之间的互相调控。例如H3K4me3对PRC2酶活性的抑制,从而阻止染色质抑制状态的延伸,维持二价状态;H4乙酰化初步打开染色质结构,然后通过H4K16ac和H2BK123ub1修饰激活Dot1 H3K79三甲基化酶活性,从而进一步打开和维持染色质的开放状态。早年的生化研究发现了很多典型的组蛋白修饰cross-talk,但是都缺乏细节机制,结构生物学的进步使得我们能够直观的观察组蛋白修饰对酶构象和活性的影响,从而更深入的了解染色质的动态调控。1. https://science.sciencemag.org/cgi/doi/10.1126/science.abc33932. https://science.sciencemag.org/cgi/doi/10.1126/science.abc66631. Suganuma, T. & Workman, J. L. Crosstalk among Histone Modifications. Cell 135, 604-607, doi:10.1016/j.cell.2008.10.036 (2008).2. Lee, J. S., Smith, E. & Shilatifard, A. The language of histone crosstalk. Cell 142, 682-685, doi:10.1016/j.cell.2010.08.011 (2010).3. Lewis, E. B. A gene complex controlling segmentation in Drosophila. Nature 276, 565-570, doi:10.1038/276565a0 (1978).4. Di Croce, L. & Helin, K. Transcriptional regulation by Polycomb group proteins. Nature structural & molecular biology 20, 1147-1155, doi:10.1038/nsmb.2669 (2013).5. Nguyen, A. T. & Zhang, Y. The diverse functions of Dot1 and H3K79 methylation. Genes & development 25, 1345-1358, doi:10.1101/gad.2057811 (2011).
文章来源:bioart